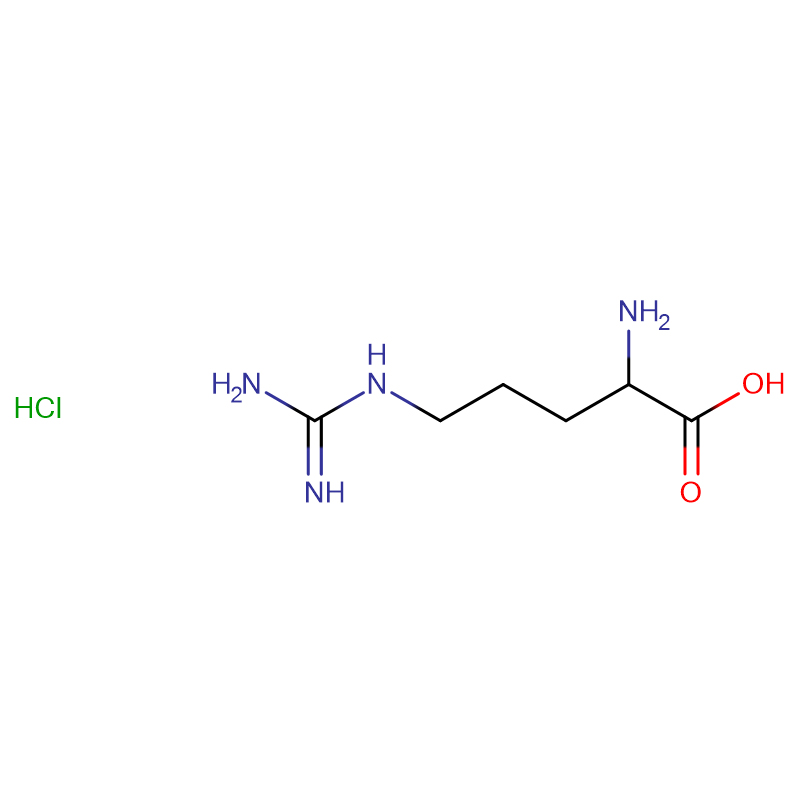
L-arginina CAS: 74-79-3 99% cristais brancos ou po cristalino
| Número de catálogo | XD90323 |
| Nome do produto | L-arginina |
| CAS | 74-79-3 |
| Fórmula Molecular | C6H14N4O2 |
| Peso Molecular | 174,20 |
| Detalles de almacenamento | Ambiente |
| Código Tarifario Harmonizado | 29252900 |
Especificación do produto
| Aparición | Cristais brancos ou po cristalino |
| Ensaio | 99 % |
| Identificación | Absorción infravermella |
| Perda por secado | ≤ 0,5 % |
| Pureza cromatográfica | Non se atopa máis do 0,5% das impurezas individuais ; Non se atopa máis do 2,0% das impurezas totais |
| Residuo na ignición | ≤ 0,3 % |
| Metais pesados (PB) | ≤ 0,0015 % |
| Ferro (como Fe) | ≤ 0,003 % |
| Sulfato (como SO4) | ≤ 0,03 % |
| Grao Usp | USP 33 |
| Cloruro (CI) | ≤ 0,05 % |
| Rotación específica [ α ] D 2 5 | +26,3 ° ~ +27,7 ° |
O mecanismo de Mycobacterium smegmatis G (MbsG), unha l-lisina monooxixenase dependente da flavina, investigouse en condicións de estado estacionario e de reacción rápida utilizando efectos de isótopos cinéticos primarios e disolventes, análogos de substrato, pH e efectos de viscosidade do disolvente como sondas mecanicistas.Os resultados suxiren que a l-lisina únese antes do NAD(P)H, o que leva a unha diminución da constante de velocidade para a redución de flavina.A unión da l-lisina non ten ningún efecto sobre a taxa de oxidación da flavina, que ocorre nun proceso dun paso sen a observación dun intermedio C4a-hidroperoxiflavina.Efectos similares determináronse con varios análogos de substrato.A oxidación da flavina é independente do pH mentres que os perfís de pH kcat/Km e kred/KD para NAD(P)H presentan valores de pKa únicos de ∼6,0, cunha actividade crecente a medida que o pH diminúe.A menor pH, a enzima desacoplase, producindo máis peróxido de hidróxeno e superóxido.A transferencia de hidruros limita parcialmente a velocidade a pH neutro e faise máis limitante a pH baixo.Observouse un efecto inverso da viscosidade do disolvente en kcat/Km para NAD(P)H a pH neutro, mentres que un efecto da viscosidade do disolvente normal se observou a pH máis baixo.Xuntos, os resultados indican un mecanismo único no que se produce un cambio conformacional limitante e sensible ao pH na semireacción redutiva, o que afecta a eficiencia da hidroxilación da lisina.