GSH Cas: 70-18-8 98% Po cristalino branco
| Número de catálogo | XD90227 |
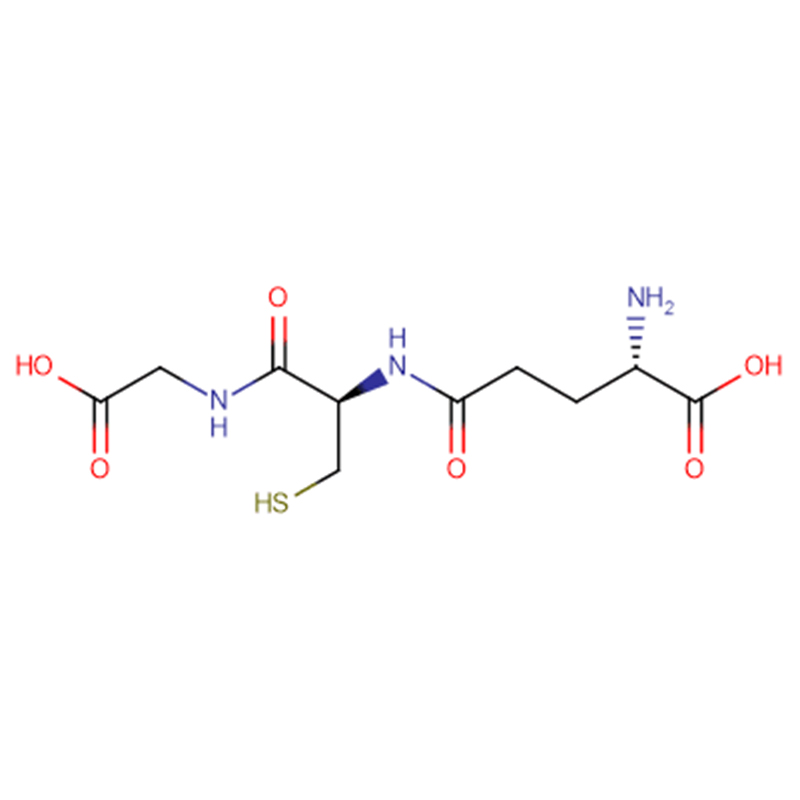
| Nome do produto | GSH |
| CAS | 70-18-8 |
| Fórmula Molecular | C10H17N3O6S |
| Peso Molecular | 307.323 |
| Detalles de almacenamento | 2 a 8 °C |
| Código Tarifario Harmonizado | 29309098 |
Especificación do produto
| Especificación do produto | |
| Punto de fusión | 185 °C |
| Grao | Grao Farmacéutico |
| Metais pesados | 10 ppm máx |
| Arsénico | 2 ppm máx |
| Identificación | IR: Similar ao espectro de referencia |
| Perda por secado | 0,5% máx |
| Temperatura de almacenamento | +20 °C |
| Peso Molecular | 612,63 |
| Ensaio | 98,0% mín |
| Rotación óptica | -15,5°- -17,5° |
| Residuo na ignición | 0,1% máx |
| Claridade da solución | Claro e incoloro |
| Aparición | Po cristalino branco |
| Substancia relacionada | Total: 2,0 % máx., GSSG: 1,5 % máx |
A proteína ORF45 do herpesvirus asociado ao sarcoma de Kaposi (KSHV) é unha proteína do tegumento inmediato e precoz específica do gammaherpesvirus.Os nosos estudos anteriores revelaron os seus papeis cruciais tanto nas fases iniciais como nas últimas da infección por KSHV.Neste estudo, investigamos o interactoma de ORF45 usando un panel de anticorpos monoclonais.Ademais das proteínas quinase regulada extracelular (ERK) e p90 ribosomal S6 quinase (RSK) identificadas previamente, atopamos outras proteínas copurificadas, incluídas destacadas de ∼38 kDa e ∼130 kDa.A espectrometría de masas revelou que a proteína de 38 kDa é ORF33 viral e a proteína de 130 kDa é a USP7 celular (protease 7 específica da ubiquitina).Mapeamos o dominio de unión a ORF33 cos 19 aminoácidos carboxilo-terminais altamente conservados (aa) de ORF45 e o dominio de unión a USP7 ao motivo de consenso informado na rexión central de ORF45.Usando a tinción de inmunofluorescencia, observamos a colocalización de ORF45 con ORF33 ou USP7 tanto en condicións transfectadas como en células infectadas por KSHV.Ademais, observamos a relocalización dependente de ORF45 dunha parte de ORF33/USP7 desde o núcleo ata o citoplasma.Descubrimos que ORF45 provocou un aumento na acumulación de proteínas ORF33 que se eliminou se se eliminaba o dominio de unión a ORF33 ou USP7 en ORF45.Ademais, a eliminación do extremo carboxilo conservado de ORF45 no xenoma de KSHV reduciu drasticamente o nivel de proteína ORF33 nas células infectadas por KSHV e aboliu a produción de virións descendentes.En conxunto, os nosos resultados non só revelan novos compoñentes do interactoma ORF45, senón que tamén demostran que as interaccións entre estas proteínas son fundamentais para a replicación lítica do KSHV. O herpesvirus asociado ao sarcoma de Kaposi (KSHV) é o axente causante de varios cancros humanos.O KSHV ORF45 é unha proteína multifuncional que é necesaria para a replicación lítica do KSHV, pero os mecanismos exactos polos que ORF45 realiza as súas funcións críticas non están claros.Os nosos estudos anteriores revelaron que toda a proteína ORF45 nas células existe en complexos de alto peso molecular.Polo tanto, buscamos caracterizar o interactoma de ORF45 para proporcionar información sobre os seus papeis durante a replicación lítica.Usando un panel de anticorpos monoclonais, investigamos o interactoma ORF45 en células infectadas por KSHV.Identificamos dous novos socios de unión de ORF45: a proteína viral ORF33 e a protease celular específica da ubiquitina 7 (USP7).Demostramos ademais que a interacción entre ORF45 e ORF33 é crucial para a produción eficiente de partículas virais do KSHV, o que suxire que a interferencia dirixida con esta interacción pode representar unha estratexia nova para inhibir a replicación lítica do KSHV.