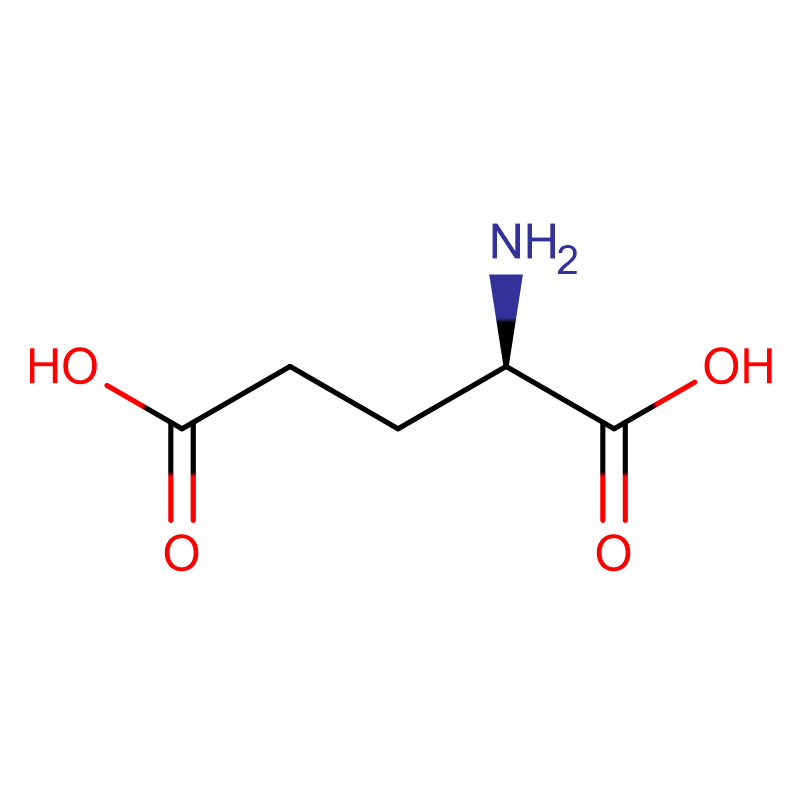
Ácido D-glutámico CAS:6893-26-1 99% Po branco
| Número de catálogo | XD90313 |
| Nome do produto | Ácido D-glutámico |
| CAS | 6893-26-1 |
| Fórmula Molecular | C5H9NO4 |
| Peso Molecular | 147.13 |
| Detalles de almacenamento | Ambiente |
| Código Tarifario Harmonizado | 29224200 |
Especificación do produto
| Aparición | Po cristalino branco |
| Ensaio | 99 % |
| Rotación específica | -31 a -32,2 |
| Metais pesados | <10 ppm |
| AS | <1 ppm |
| pH | 3 - 3.5 |
| SO4 | <0,020 % |
| Fe | <10 ppm |
| Perda por secado | <0,20 % |
| Residuo na ignición | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,02 % |
| Estado de solución | >98% |
As γ-glutamiltranspeptidases (γ-GT) cortan o enlace γ-glutamil amida do glutatión e transfiren o grupo γ-glutamilo liberado á auga (hidrólise) ou aos aminoácidos aceptores (transpeptidación).Estes encimas ubicuos xogan un papel fundamental na biosíntese e degradación do glutatión e na desintoxicación xenobiótica.Aquí informamos da estrutura cristalina de resolución de 3Å do Bacillus licheniformis γ-GT (BlGT) e a do seu complexo con l-Glu.As estruturas de raios X confirman que BlGT pertence á superfamilia das hidrolases nucleófilas N-terminais e revelan que a proteína posúe unha fenda do sitio activo aberto similar á reportada para o encima homólogo de Bacillus subtilis, pero diferente das observadas para a γ-GT humana e para γ-GTs doutros microorganismos.Os datos suxiren que a unión de l-Glu induce unha reordenación da cola C-terminal da subunidade grande BlGT e permite a identificación dun grupo de residuos ácidos que están potencialmente implicados no recoñecemento dun ión metálico.O papel destes residuos na estabilidade conformacional do BlGT foi estudado caracterizando o autoprocesamento, a actividade enzimática, a desnaturalización química e térmica de catro novos mutantes únicos de Ala.Os resultados mostran que a substitución de Asp568 por un Ala afecta tanto ao autoprocesamento como á estabilidade estrutural da proteína.